الحركة الدورانية أو حركة الاستدارة : هي حركة التفاف حول مركز الجسم نفسه، بخلاف الحركة الدائرية التي يحافظ فيها الجسم على مسافة ثابتة من مركز يقع خارجه.
وتكون الحركة دورانية منتظمة إذا كانت سرعة الدوران ثابتة، وإلا يقال عن تلك الحركة الدورانية أنها غير منتظمة لتغير سرعة الدوران .
و عزم القوة هو الذي يسبب الحركة الدورانية.
ومن أمثلة الحركة الدورانية في حياتنا :
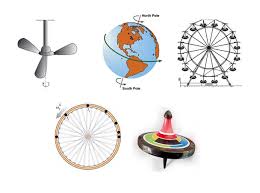
ولوصف الحركة الدورانية فإننا نحتاج الى :
1- الإزاحة
2- السرعة الزاوية المتجهة
3- التسارع الزاوي
في أي نقطة يكون تأثير القوة أكبر ؟ ولماذا ؟
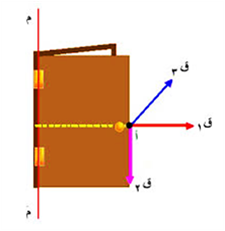
عند ق1 , لأنه اذا كانت القوة المؤثرة متعامدة مع نصف قطر الدوران فإن مقدار ذراع القوة يزيد
ذراع القوة : هي المسافة العمودية من محور الدوران حتى نقطة التأثير .
أما مقياس مقدرة القوة على إحداث الدوران فذلك يسمى بالعزم

ومنه نستنتج : يزداد العزم كلما زادت المسافة بين محور الدوران ونقطة تأثير القوى
وبالتالي فإن العزم ينعدم عندما يكون موازيا للمسافة أو القوى تساوي صفر